近日,北京大学深圳研究生院(以下简称“北大深研院”)李子刚/尹丰课题组与普林斯顿大学康毅滨教授合作,在前面研究基础上[1](J. Med. Chem. 2022, 65, 12188-12199, DOI: 10.1021/acs.jmedchem.2c00862),该工作提出了一种基于多肽纳米载体的靶向MTDH-SND1的稳定多肽递送系统,并在三阴乳腺癌治疗上取得了显著的抗肿瘤效果。其成果发表在《JACS Au》杂志上,题目为“Intracellular delivery of stabilized peptide blocking MTDH-SND1 interaction for breast cancer suppression”,并且被评为封面文章。

基于前面的研究,该工作选取MTDH与SND1蛋白结合的序列MS2D(DWNAPAEEWGNWVDE)作为出发点,结合分子对接,保留Trp394和Trp403的基础上,突变396位Ala成Glu,目的是通过增加侧链酸性氨基酸以增强与SND1蛋白的静电作用进而增强结合力。并在此基础上进行末端天冬氨酸交联环化,以维持多肽的二级构象。结合实验表明,突变并且环化修饰的多肽NS-E相比MS2D多肽以及前面开发的MS2D-cyc4和MS2D-cyc6与SND1蛋白的结合亲和力有了3-4倍的提高,可作为进一步研究的候选化合物。然而,稳定多肽 NS-E依然面临着穿膜能力有限(尤其在4T1 细胞中)、起效剂量较高(IC50>100 μM)等问题。
鉴于稳定多肽NS-E含有较多负电荷的氨基酸,因此引入此前开发的一条9个氨基酸的锍盐多肽Wpc载体[2],利用Wpc载体提高稳定多肽的细胞摄取能力,从而降低多肽的给药浓度并且提高多肽体内外的抗肿瘤疗效。Wpc多肽载体能与NS-E多肽组装形成纳米颗粒,协助NS-E多肽穿膜。一系列生物实验表明稳定多肽NS-E在与Wpc载体混合后可以显著增强NS-E在肿瘤细胞的细胞摄取能力,并且在细胞内可以有效地靶向SND1蛋白并干扰MTDH-SND1蛋白复合物的形成,进而促进三阴乳腺癌细胞的凋亡并抑制三阴性乳腺癌细胞的生长、迁移和侵袭。此外,Wpc/NS-E多肽复合物在小鼠4T1三阴乳腺癌模型中也表现出不错的治疗效果,可作为治疗三阴性乳腺癌的潜在疗法。
除此之外,论文还对Wpc/NS-E多肽复合物可能影响的细胞信号通路进行了转录组学的分析。RNA-Seq 结果表明,Wpc/NS-E显著调节了Wnt/β-catenin、NF-κB、PI3K/AKT等致癌基因相关的信号通路,并抑制趋化因子基因(如CXCL2、CX3CL1、CSF2、TGFB2等)的表达。与此同时,Wpc/NS-E处理后还影响了与氨基酸生物合成和代谢相关等其他途径,为MTDH-SND1药物的开发和靶向治疗三阴性乳腺癌提供了参考。
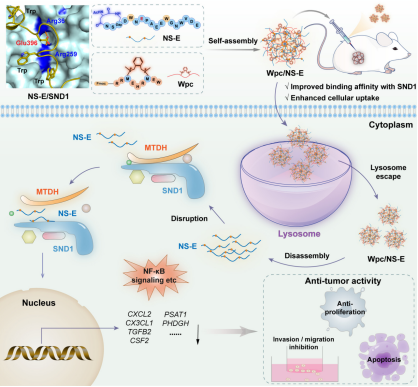
靶向MTDH-SND1复合物的稳定多肽的递送和在治疗乳腺癌的应用示意图
北大深研院博士研究生陈海灵为论文第一作者,深圳湾实验室坪山生物医药研发转化中心尹丰研究员,北大深研院李子刚教授、以及普林斯顿大学康毅滨教授为该论文的共同通讯作者,坪山中心詹美苗博士、张亚萍博士、刘健博,王蕊博士亦对本论文做出了重要贡献。此外,该工作还得到了安禹豪、高展霞、姜乐盈、邢韵等人的支持和帮助。该研究得到了国家科技部、国家自然科学基金、广东自然科学基金、深圳市科技创新委员会等基金的支持。
全文链接:https://pubs.acs.org/doi/10.1021/jacsau.3c00573
[1] Chen, H.; Zhan, M.; Liu, J.; Liu, Z.; Shen, M.; Yang, F., et al. Structure-Based Design, Optimization, and Evaluation of Potent Stabilized Peptide Inhibitors Disrupting MTDH and SND1 Interaction. J. Med. Chem. 2022, 65, 12188-12199.
[2] Li, W.; Wang, D.; Shi, X.; Li, J.; Ma, Y.; Wang, Y., et al. A siRNA-induced peptide co-assembly system as a peptide-based siRNA nanocarrier for cancer therapy. Mater. Horiz. 2018, 5, 745-752.